Net nedideli vieno iš fermentų veikimo sutrikimai gali tapti ligos priežastimi, o jų katalizuojamų reakcijų ar veiklos produktų analizė sveikose ir sergančių organizmų ląstelėse leidžia diagnozuoti ligą ar parinkti terapijos būdą.
Atlikdami tyrimus mokslininkai ir medikai susidūrė su problema, kad daugelis įprastų cheminių reakcijų, puikiai vykstančių laboratorinėmis sąlygomis, netinka daugialypėje ląstelės aplinkoje vykstantiems procesams tirti ar molekulėms, turinčioms naujų savybių, gaminti. Gyvuose organizmuose vykstančių „click“ cheminių reakcijų taikymas lemtingai pakeitė šią situaciją.
„Click“ technologija leidžia gaminti ląsteles, pasižyminčias naujomis funkcijomis
Vilniaus universiteto Gyvybės mokslų centro biotechnologai kartu su Chemijos ir geomokslų fakulteto chemikais taiko modifikuojančius fermentus metiltransferazes epigenetiniams, epitranskriptomo ar RNR sudėties tyrimams, taip pakeisdami jų vykdomas reakcijas, kad jos perneštų specifinių substratų chemines grandines su negamtinėmis „click“ cheminėms reakcijoms tinkamomis funkcinėmis grupėmis ant specifinių DNR ar RNR taikinių.
„Click“ reakcijos leidžia efektyviai prijungti dominančias chemines grupes prie ląstelėje esančių biomolekulių ir taip analizuoti jų vietą ir kiekį, specifinių signalų pokyčius ar net gaminti cheminius junginius, vaistus ar ląsteles, pasižyminčias naujomis funkcijomis.
Kadangi šiai reakcijai reikalingų sudėtingų substratų cheminė sintezė dažnai yra brangi ar net neįmanoma, Vilniaus universiteto mokslininkai bando unikaliai sujungti cheminius ir biologinius metodus tokiems substratams gaminti.
Cheminiai procesai vyksta visur
Daugumai žmonių chemijos sąvoka asocijuojasi su valymo priemonėmis. Dažnai netgi įvairius maisto produktų konservantus, įskaitant natūraliai aptinkamus gamtoje, tūlas pilietis irgi pavadina „chemija“.
Ar žinojote, kad visi gyvybiniai procesai, vykstantys mūsų kūne, yra cheminės reakcijos arba glaudžiai su jomis susiję? Būtent šios reakcijos organizmo ląstelėse palaiko ir užtikrina gyvybę. Pavyzdžiui, kvėpavimo metu išsiskiriantis CO2 susidaro organizme vykstant sudėtingoms cheminėms reakcijoms, kurios yra žmogaus metabolizmo dalis.
Dauguma vartojančių vaistus net nesusimąsto, kaip jų organizmą veikia kas rytą ir vakarą geriama „chemija“ – svarbus tik rezultatas: mažesnis kraujo spaudimas, išnykęs galvos skausmas ar stabilizuotas gliukozės kiekis. O iš tiesų vaistinės medžiagos reguliuoja organizmo metabolizmą: vieni vaistai stabdo ar sulėtina vykstančias chemines reakcijas, kiti atvirkščiai – sudaro sąlygas joms vyksti ar jas pagreitina, o treti, sąveikaudami su ląstelės receptoriais, keičia medžiagų įsisavinimą organizme.
Visiems gerai žinomas aspirinas modifikuoja tam tikrą fermentą ir sustabdo jo veikimą. Dėl to organizme gaminasi mažiau medžiagų, vadinamų prostaglandinais ir tromboksanais. Prostaglandinai yra atsakingi už uždegiminius procesus, o tromboksanai padeda kraujui krešėti. Štai kodėl aspirinas malšina skausmą, pasižymi uždegimą slopinančiomis savybėmis ir mažina kraujo krešėjimą.
Daugelis cheminių reakcijų netinka ląstelės procesų tyrimams
Sumaišę tinkamomis sąlygomis tarpusavyje sąveikaujančias medžiagas ir reakciją skatinančius katalizatorius cheminiams bandymams atlikti skirtame inde, galime gana tiksliai prognozuoti cheminės reakcijos eigą. Tačiau daug sunkiau manipuliuoti gyvų organizmų cheminėmis reakcijomis siekiant konkrečių tikslų ar ląstelėse vykdyti naujas chemines reakcijas, kurios nėra užprogramuotos mūsų genome – mūsų DNR.
Taigi kaip galime paveikti ląstelėje vykstančias reakcijas ar net sukelti tokias, kurios ląstelei įprastai nebūdingos? Ląstelę galima palyginti su cheminiu indu, tik izoliuotu nuo aplinkos ne stiklo sienele, o ląstelės plazmine membrana. Tačiau natūraliai ląstelėje vyksta daugybė cheminių reakcijų ir joje gausu įvairių reaktyvių grupių. Įvedus į ląstelę papildomų reagentų, kad įvyktų dar viena reakcija, jie nebūtinai reaguos tik tarpusavyje, o gali sąveikauti su aibe junginių, jau esančių daugialypėje ląstelės aplinkoje.
Norint parinkti tinkamas chemines reakcijas, reikia atsižvelgti į veiksnius, lemiančius cheminės reakcijos tarp junginių vykimą. Atmetus sunkiai ląstelėje kontroliuojamas sąlygas, tokias kaip temperatūra ir slėgis, lieka junginio struktūra, kurią apibrėžia atomų išsidėstymo tvarka molekulėje.
Ši tvarka lemia struktūrinių molekulės fragmentų – funkcinių grupių, kurioms reaguojant tarpusavyje vyksta reakcijos tarp molekulių, atsiradimą. Jei pasitelksime medžiagas, turinčias funkcines grupes, kurios natūraliai aptinkamos ląstelėje, nekontroliuojamos reakcijos gali įvykti ne tik tarp tikslinių molekulių, bet ir tarp kitų ląstelės komponentų.
Tik tuo atveju, jei į ląstelę įvedamos medžiagos turės reaktyvias funkcines grupes, neaptinkamas gyvojoje gamtoje ir nereaguojančias su ląstelėje esančiais junginiais, jos nedarys įtakos natūraliai ląstelėje vykstančioms reakcijoms. Tokios reakcijos yra vadinamos bioortogonaliomis ir leidžia suformuoti kovalentinį ryšį (cheminis ryšys, atsirandantis susidarant bendroms elektronų poroms) tarp dviejų junginių, iš kurių bent vienas gali būti ir modifikuota biomolekulė.
Biologinėms sistemoms pritaikytų cheminių reakcijų atradimas atvėrė naujus taikymo horizontus daugelyje sričių, ne tik moksliniuose tyrimuose, bet ir medicinoje, diagnostikoje, medžiagų chemijoje ir biokatalizėje.
Reakcijos, įvertintos Nobelio premija
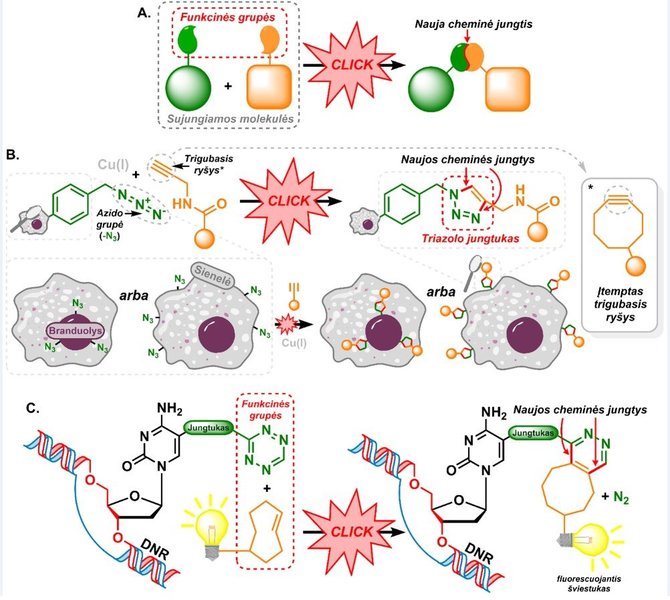
Funkcinių grupių, kurios gali dalyvauti bioortogonaliose reakcijose, pasirinkimas nėra gausus. Šiuo metu populiariausia bioortogonalių funkcinių grupių pora yra azido grupė, kurią sudaro trys linijiniu būdu tarpusavyje susijungę azoto atomai, ir alkino grupė, sudaryta iš dviejų anglies atomų, sujungtų trigubuoju ryšiu.
Šios grupės reaguoja tarpusavyje, sudarydamos triazolo jungtuką.
Karlas Barry Sharplessas, vadovavęs chemikų grupei, kuri išplėtojo šią vienvalenčio vario druskų katalizuojamą reakciją, pavadino ją „click“ reakcija. Šis pavadinimas atspindi didelį reakcijos greitį ir efektyvumą – tik spragt (angl. click) ir viskas baigta. Tačiau reakcijai būtinos vario druskos biologinėje aplinkoje sąveikauja su baltymais ir taip keičia jų savybes, veikia nukleorūgštis – todėl ląstelėje pritaikyti šią reakciją būtų sunkiai išsprendžiama problema. Galvodama apie tai, Carolyn Ruth Bertozzi su kolegomis pasiūlė vietoje įprasto trigubojo ryšio naudoti aktyvesnį jo analogą – įtemptą trigubąjį ryšį.
Šioms azido-alkino reakcijoms vario druskos nėra būtinos, todėl jos geriau tinka dirbant su biomolekulėmis ar biologinėje terpėje.
Taigi kur galime panaudoti „click“ reakcijas? Kolboje mes galime sujungti dvi ypač sudėtingas molekules su daugybe skirtingų funkcinių grupių tarpusavyje, jei vienoje yra azido grupė, o kitoje – trigubasis ryšys. O štai gyvuose organizmuose ar ląstelėse mes dėl šios reakcijos galime pažymėti norimus molekulinius taikinius. Įterpus į organizmą molekulę, turinčią azido grupę, o paskui į jį įvedant molekulę su trigubuoju ryšiu ir prijungta žyme, pavyzdžiui, fluorescenciniu dažu, pažymėsime organizme vietas, kuriose lokalizavosi azido grupę turinti molekulė. Tokiu būdu gali būti vizualizuojami ląstelės paviršiuje išsidėstę karbohidratai, kurie yra atsakingi už ląstelių tarpusavio sąveiką, be to, gali tarnauti žymenimis vėžinėse ląstelėse. Analogiškai galime pažymėti ląstelės branduolį, prieš tai funkcionalizavę DNR azido grupe.
Pripažindama šio atradimo svarbą, Švedijos karališkoji mokslų akademija 2022 m. apdovanojo K. B. Sharplessą, Morteną Meldalį ir C. R. Bertozzi prestižine Nobelio premija už „click“ reakcijos sukūrimą ir jos pritaikymą biologinėse sistemose.
Kodėl organizmą sudarančios ląstelės skiriasi?
Visos žmogaus organizmą sudarančios ląstelės turi identišką genetinį kodą, tai yra iš cheminių raidžių – DNR nukleotidų sudarytą vienodą tekstą, kuriame yra užkoduota paveldima informacija.
Tačiau skirtingų audinių ar organų ląstelės nėra panašios – jos gali skirtis tiek morfologija, tai yra savo forma, tiek atliekamomis funkcijomis. Pavyzdžiui, odos ląstelės kaip skydas saugo organizmą, kad nepatektų mikroorganizmų, kad neatsirastų mechaninių ar cheminių pažeidimų, po jomis esantis melanocitų sluoksnis sintetina melaniną, kuris apsaugo nuo žalingo ultravioletinės spinduliuotės poveikio. Tuo tarpu kasos ląstelės atlieka daug funkcijų, iš kurių viena yra gliukozės koncentracijos kraujyje palaikymas.
Kyla klausimas: kodėl organizmo ląstelės skiriasi, jei visos jos vadovaujasi ta pačia instrukcijų knyga? Paaiškėjo, kad kiekvienas ląstelių tipas naudoja tik tam tikras genetinio kodo dalis, o svarbų vaidmenį paženklinant, kurių konkrečių instrukcijos knygos dalių – genų – nereikia skaityti, vaidina specialūs cheminiai ženklai – metilo grupės.
Jie nekeičia genetinio teksto, todėl vadinami epigenetinėmis žymėmis. Nuskaitydama tik reikiamų genų koduojamą informaciją, kiekviena ląstelė gauna specifinį funkcinių RNR ir baltymų rinkinį, kuris ir nulemia jos savybes. Ypač svarbi baltymų grupė – fermentai, kurie atlieka lemiamą vaidmenį saugant ir perduodant genetinę informaciją, skaidant maisto medžiagas energijai gauti ir kuriant naujus ląstelių komponentus, reguliuojant molekulių judėjimą ląstelės viduje, reaguojant į aplinkos pokyčius ir stresą ar net sąveikaujant su kitomis ląstelėmis.
Būtent genomą modifikuojantys fermentai – DNR metiltransferazės yra atsakingos už epigenetinių metilo žymių uždėjimą ant specifinių DNR molekulės vietų, kurios būtinos anksčiau minėtai genų aktyvumo reguliacijai.
Kita fermentų grupė – RNR metiltransferazės – uždeda metilo žymes ant reikiamų RNR molekulių ir taip palaiko jų stabilumą. RNR ląstelėje yra atsakinga už baltymų sintezę ir šio proceso reguliavimą, taip pat gali katalizuoti chemines reakcijas. RNR visuma sudaro transkriptomą, kurio funkcionavimą reguliuoja epitranskriptominiai veiksniai, tokie kaip metilo grupės. Baltymus modifikuojančios metiltransferazės gali turėti įtakos genų nuskaitymo efektyvumui ar baltymų veikimui ir stabilumui ląstelėse.
Metiltransferazės atlieka gyvybiškai svarbų vaidmenį palaikant ląstelės funkcijas, todėl, sutrikus šių fermentų veiklai organizme, suardomas biologinių procesų reguliavimas, o tai gali sukelti įvairius sveikatos sutrikimus, pavyzdžiui, vėžinius susirgimus, neurodegeneracines ar imunodeficitines ligas. Būtent „click“ reakcijų pritaikymas leistų geriau suprasti ligų etiologiją ir padėtų kuriant ankstyvesnio ligų aptikimo metodus. Tokius epigenetinius, epitranskriptominius ir RNR tyrimus, grindžiamus „click“ metodo pritaikymu, Vilniaus universitete vykdo prof. Viktoro Masevičiaus ir prof. Giedriaus Vilkaičio vadovaujama jungtinė chemikų ir biologų komanda, į kurią, be minėtų mokslininkų, dar įeina dr. Gražina Petraitytė, dokt. Martynas Malikėnas ir dokt. Bernadeta Masiulionytė.

Tyrimai leidžia geriau suprasti ligų atsiradimo priežastis
Postūmį pradėti epigenetinius ir epitranskriptominius tyrimus Vilniaus universitete davė prof. Sauliaus Klimašausko ir Elmaro Weinholdo idėjos, pasiūlytos prieš du dešimtmečius.
Ypač domimasi fermentais metiltransferazėmis, kurios uždeda žymes specifinėse makromolekulių, tokių kaip DNR, RNR ar baltymai, vietose, svarbiose jų atliekamoms funkcijoms.
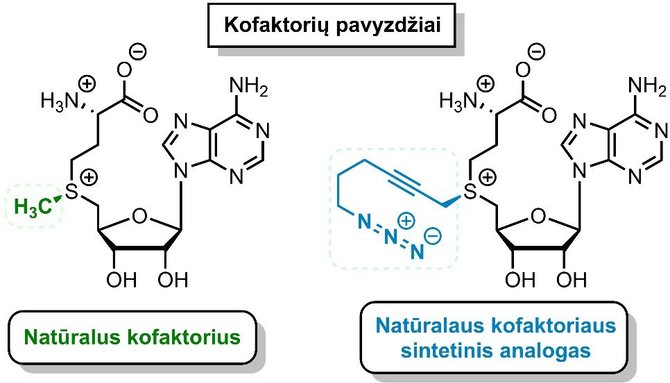
Natūraliai metiltransferazės perneša nedidelę metilo grupę, kuri yra sudaryta iš vieno anglies ir trijų vandenilio atomų. Chemiškai ši žymė nėra aktyvi, todėl dažnai netinka epigenetiniams signalams profiliuoti ar epigenetiniams procesams tirti. Todėl Vilniaus universitete vykdomas platus tyrimas, kuriuo siekiama praplėsti gamtos nulemtas fermentų veikimo ribas, kad jie galėtų ant tiriamų biomolekulių pernešti ilgas ir chemiškai aktyvias funkcines grupes. Tokias grupes metiltransferazės paima nuo sudėtingų cheminių junginių, vadinamų kofaktoriais.
Kadangi daugumą jų yra sudėtinga ar net neįmanoma sintetinti cheminiais metodais, Vilniaus universiteto mokslininkai pritaikė chemofermentinį būdą, kai reikiamas kofaktorius yra sukuriamas naudojant fermentą, sujungiantį du paprastesnius, chemiškai susintetintus junginius. Naujų kofaktorių, kurie turi chemiškai aktyvias grupes, naudojimas metiltransferazių reakcijose atvėrė galimybę specifinėse genomo vietose pažymėti DNR ar RNR molekules ir praplėsti epigenetikos srityje naudojamų metodų spektrą.
Pavyzdžiui, prie funkcinės azido ar tetrazino grupės „click“ chemijos būdu galime prijungti fluorescuojančias medžiagas. Dėl tokių šviečiančių junginių lengvai galime vizualizuoti ir stebėti ląstelėje esančių DNR ar RNR makromolekulių lokalizaciją. Be to, taikydami šiuos molekulinius įrankius galime tiksliau įvertinti epigenetinių ir epitranskriptominių signalų pokyčius ir geriau suprasti ligų atsiradimo priežastis ar svarbių biologinių procesų eigą.
Taigi sujungdami biologinius ir cheminius metodus ir pasitelkdami fermentus, gebančius sintetinti reikiamus substratus su ilgesnėmis žymėmis, prof. V. Masevičiaus ir prof. G. Vilkaičio grupės nariai tikisi dar labiau praplėsti metiltransferazių panaudojimą biologiniuose ir medicininiuose tyrimuose.