Informacija apie klinikiniuose tyrimuose dalyvaujančius žmones, kaip ir bet kurio paciento sveikatos būklę, yra konfidenciali, tai yra neviešinama. Tačiau pacientų organizacijos, esančios arčiausiai savo narių, teigia nesusidūrusios su baimėmis dėl dalyvavimo klinikiniuose tyrimuose. Lietuvos pacientų atstovų organizacijos prezidentė Vida Augustinienė sako, kad nėra asmeniškai dalyvavusi klinikiniuose vaistų tyrimuose, nes niekas jai to ir nesiūlė.
„Aš manau, kad dalyvaudami tyrimuose pacientai turi galimybę nemokamai gauti gydymą naujausiais vaistais. Be to, jiems nuolat atliekami reikalingiausi sveikatos tyrimai. O paaiškėjus, kad vaistai netinka, žmogus turi teisę tuoj pat pasitraukti iš tyrimo“, – pabrėžia V. Augustinienė ir priduria, kad tyrime dalyvavęs vienas jos namiškių liko patenkintas.
Lietuvos pacientų organizacijų atstovų tarybos nariai dalyvauja Vilniaus ir Kauno regioninių biomedicininių tyrimų etikos komitetų posėdžiuose.
Onkohematologinių ligonių asociacijos „Kraujas“ prezidentės Dalios Bielskytės teigimu, nemažai ligonių norėtų dalyvauti klinikiniuose vaistų tyrimuose, bet apgailestauja, kad Lietuvoje nedaug tiriama naujų kraujo vėžiui įveikti skirtų vaistų. „Klinikiniai tyrimai – tai viltis ir galimybė pasveikti“, – sako D.Bielskytė.
Klinikiniai tyrimai – tai viltis ir galimybė pasveikti, sako D.Bielskytė.
Klinikinių tyrimų pradžia – XVIII a.
Pasak Lietuvos bioetikos komiteto (LBEK) direktoriaus, docento Eugenijaus Gefeno, klinikiniai ir biomedicininiai tyrimai – neatsiejama medicinos mokslo dalis. Be biomedicininių tyrimų neįmanoma medicinos pažanga, naujų veiksmingesnių vaistų, padedančių išgydyti ligonius, pailginti jų gyvenimo trukmę, pagerinti gyvenimo kokybę, atsiradimas. Biomedicininiai tyrimai nėra naujas dalykas žmonijos istorijoje.
Klinikinių tyrimų, kaip juos suprantame šiandien, pradžia – XVIII a. Jau tuomet, pasitelkiant kontrolines žmonių grupes, buvo nustatytos efektyvios priemonės nuo skorbuto, atrasta vakcina nuo raupų. Pavyzdžiui, vieną pirmųjų sėkmingų bandymų 1747 m. atliko anglų gydytojas Jamesas Lindas, norėdamas išsiaiškinti, ar citrusinių vaisių (vitamino C) vartojimas gali gydyti skorbutą ar padėti jo išvengti.
Tačiau griežtai reglamentuota, standartizuota šiuolaikinių tyrimų istorija prasidėjo maždaug XX amžiaus antrojoje pusėje, kai atsirado tarptautiniai ir nacionaliniai norminiai dokumentai, nustatantys tiek mokslinius ir procedūrinius standartus, tiek tiriamųjų teisių apsaugos reikalavimus. Visų dokumentų pagrindinis principas – savanoriškai tyrimuose dalyvaujančio paciento interesai svarbesni už visuomenės ar mokslo interesus.
Išsami informacija privaloma
Biomedicininių tyrimų etinio vertinimo sistema Lietuvoje, grįsta tuo pačiu savanoriškumo ir paciento interesų viršenybės principu, pradėta kurti atkūrus Nepriklausomybę. Įstojusios į Europos Sąjungą Lietuvos teisės aktai buvo suderinti su ES direktyvomis. Remiantis Lietuvos biomedicininių tyrimų etikos ir Lietuvos farmacijos įstatymais, užsakovas, norėdamas vykdyti klinikinio vaistinio preparato tyrimą Lietuvoje, privalo gauti LBEK pritarimo liudijimą ir VVKT leidimą. Tokį reikalavimą įtvirtina ne tik Lietuvos, bet ir ES teisės aktai. ES rekomendacijose pabrėžiama bendradarbiavimo, keitimosi informacija svarba, atskiriant šių dviejų institucijų kompetenciją.
Šios dvi institucijos, bendradarbiaudamos skirtingose kompetencijos srityse, analizuoja su tiriamu preparatu susijusius klausimus, informaciją apie preparato saugumą ir kokybę, vykdomo tyrimo etinius aspektus, pacientui pateikiamos informacijos turinį. Pacientas į klinikinius tyrimus įsitraukia tik gavęs privalomą išsamią informaciją apie tyrimo tikslus, metodus, galimą riziką. Dar labai svarbu pabrėžti, kad suabejojęs tyrimu žmogus gali nedelsdamas iš jo pasitraukti, grįžti prie įprastinių sveikatos priežiūros paslaugų.
Atsakomybė reglamentuota
Kaip pabrėžia LBEK vadovas E.Gefenas, medicinos mokslui svarbūs ne tik klinikiniai, vaistų tyrimai, bet ir kitų gydymo būdų ar metodų, taip pat žmogaus biologinės medžiagos ar žmogaus sveikatos duomenų tyrimai. Visi medicinos mokslo tyrimai (biomedicininiai tyrimai) Lietuvoje griežtai reglamentuojami Biomedicininių tyrimų etikos, Farmacijos įstatymuose, Sveikatos apsaugos ministro įsakymuose.
 |
| ./Eugenijus Gefenas |
„Tyrimai leidžiami tik tuomet, kai neabejojama jų moksline ir praktine verte, yra garantuojama tiriamojo interesų apsauga bei informacijos apie tiriamąjį konfidencialumas, gautas savanoriškas tiriamojo asmens sutikimas, tyrėjo ir biomedicininių tyrimų užsakovo civilinės atsakomybės draudimas dėl galimos žalos tiriamajam“, – sako E.Gefenas.
Lietuva laikosi 1997 m. Konvencijos dėl žmogaus teisių ir orumo apsaugos biologijos ir medicinos taikymo srityje reikalavimų, Geros klinikinės praktikos taisyklių, Helsinkio deklaracijos.
„Taigi, galima teigti, kad ne tik klinikinių tyrimų atlikimo principai, bet ir procedūriniai dalykai, reikalavimai tyrėjams ir tyrimų užsakovams bei jų atsakomybė yra išsamiai reglamentuojami tiek Lietuvos, tiek tarptautinių institucijų dokumentuose ir privalomi tyrimus vykdantiems tyrėjams ir tyrimų užsakovams. Už netinkamą, neteisėtą tyrimų atlikimą Lietuvoje numatyta net baudžiamoji atsakomybė“, – pabrėžia E.Gefenas.
Griežto nuoseklumo principai
Doc. E.Gefenas pažymi, kad naujo vaistinio preparato gamyba – ilgas, sudėtingas ir brangus procesas. Vaistų kelias nuo ikiklinikinių tyrimų (t.y. tyrimų su gyvūnais) pradžios iki jo įregistravimo ir skyrimo pacientams dažniausiai užtrunka apie 10 metų.
Tyrimai leidžiami tik tuomet, kai neabejojama jų moksline ir praktine verte, teigia E.Gefenas.
„Tiriant vaistinius preparatus visada laikomasi griežto nuoseklumo: prieš pradedant tyrimus su žmonėmis (klinikinius tyrimus) atliekami išsamūs ikiklinikiniai tyrimai. Pirmosios fazės klinikiniai tyrimai, kai vaistai pirmą kartą skiriami žmonėms, paprastai atliekami su sveikais savanoriais (išskyrus tam tikrus vaistus, kurie gali būti skiriami tik tam tikromis ligomis, pvz., onkologinėmis, sergantiems pacientams)“, – sako E.Gefenas. Vėliau (atliekant II–III fazės tyrimus) vaistiniai preparatai pradedami skirti tam tikra liga sergantiems pacientams griežtai kontroliuojamomis sąlygomis.
Dar griežtesni apsaugos reikalavimai taikomi tam tikroms pacientų grupėms, kurios dėl tam tikrų aplinkybių (amžiaus, sveikatos būklės, priklausomybės nuo tyrėjo ir t.t.) laikomos pažeidžiamomis tiriamųjų grupėmis (pvz., vaikai, psichikos ligomis sergantys asmenys, tyrėjui pavaldūs asmenys). Juos įtraukiant į klinikinius tyrimus taikoma dar griežtesnė apsauga: tyrimai su jais gali būti atliekami tik jei tyrimo negalima atlikti su kitais pacientais (pvz., tiriami vaikams skirti vaistai).
Daugiacentriai tyrimai
Pasak VVKT viršininko Gintauto Barcio, Lietuvoje daugiausia atliekama III fazės tyrimų, t.y. kai ankstesnėse fazėse jau yra sukaupti preliminarūs duomenys apie tiriamų vaistų saugumą ir veiksmingumą. III fazės tyrimuose dalyvauja iki kelių tūkstančių tiriamųjų skirtingose valstybėse. Tokie daugiacentriai tyrimai atliekami dėl to, kad per trumpesnį laikotarpį būtų į tyrimą įtrauktas reikiamas pacientų skaičius. Doc. E. Gefenas pažymi, kad ir III fazėje tiriami vaistai dažniausiai yra neregistruoti, todėl visuomet išlieka tam tikra nepageidaujamos reakcijos rizika.
„Kita vertus, juk ir vartojant registruotus vaistus ar atliekant įprastas medicinos procedūras susiduriama su šalutinio poveikio grėsme, – pabrėžia E. Gefenas.
Lietuvos teisės aktuose reglamentuojama, kad klinikinis tyrimas turi būti atliekamas tik pagal VVKT ir Etikos komiteto patvirtintą tyrimo protokolą, kuriame detaliai apibrėžiama, kaip gali vykti tyrimas. Lietuvoje tyrimo užsakovu gali būti Europos Bendrijoje įsisteigęs juridinis asmuo. Taip pat Europos Bendrijoje turi būti įsteigtas užsakovo deleguotas kvalifikuotas asmuo, atsakingas už tiriamojo vaistinio preparato kokybę. Pasak VVKT viršininko Gintauto Barcio, griežti gamybos standartai galioja visiems tiriamiems vaistams taip pat kaip ir jau registruotiems preparatams. „Nors vaistinis preparatas dar tik klinikinių tyrimų fazės, jo gamyba turi atitikti Europos Bendrijoje patvirtintas vadinamąsias Geros gamybos praktikos taisykles, – pabrėžia G. Barcys. – Tyrimo eigoje užsakovas yra įpareigotas derinti bet kokius nukrypimus nuo protokolo su leidimą (pritarimo liudijimą) tyrimui išdavusiomis institucijomis, t.y. su VVKT, LBEK.“
Kas žinotina tiriamajam
Žmogus, kuriam pasiūloma dalyvauti tyrime, turi žinoti, kad tik jis pats nusprendžia dalyvauti tyrime, ar ne. Kad ir koks būtų sprendimas, tai niekaip negali paveikti pacientui teikiamos sveikatos priežiūros paslaugų.
Prieš įtraukiant į tyrimą žmogui turi būti pateikiamas dokumentas su visa svarbiausia informacija. Dokumentas vadinamas Asmens informavimo ir informuoto asmens sutikimo forma. Šioje formoje išdėstoma informacija apie tyrimo tikslą, planą, taikomus metodus, Lietuvos bioetikos komiteto ar atitinkamo regioninio biomedicininių tyrimų etikos komiteto sprendimus, numatomą tyrimo naudą tiriamajam, jo teises, galimą riziką bei nepatogumus, taip pat galimos žalos atlyginimo tvarką. Pabrėžtina, kad tiriamasis bet kuriuo metu turi teisę atšaukti raštu savo sutikimą dalyvauti tyrime. Tyrimą atliekanti institucija garantuoja informacijos apie tiriamojo sveikatą konfidencialumą.
Priimant sprendimą dėl dalyvavimo tyrime pacientui nereikia skubėti, būtina perskaityti dokumentą, nebijoti klausti ir su tyrime siūlančiu dalyvauti gydytoju išsiaiškinti visus rūpimus klausimus. Esant reikalui pasitarti su giminėmis ar kitais asmenimis.
Jei kyla klausimų dėl tyrimo teisėtumo ar dėl savo, kaip tiriamojo teisių, žmogus gali kreiptis į leidimus išdavusias institucijas (VVKT ir Lietuvos bioetikos komitetą), informaciją apie Lietuvoje vykstančius tyrimus galima rasti šių institucijų interneto svetainėse.
***
2011 m. VVKT svarstė 96 prašymus dėl klinikinių tyrimų.
Pritarta 89 prašymams
4 prašymai atmesti
3 užsakovai paraiškas atsiėmė
80 proc. Lietuvoje atliekamų klinikinių tyrimų yra 3–4 fazės
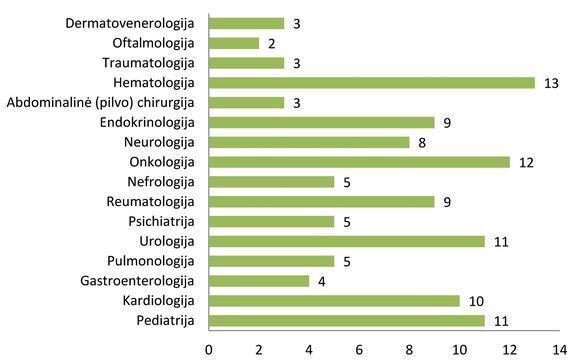
2011 m. klinikinių vaistinių preparatų tyrimų paskirstymas pagal medicinos sritis:
 |
||
|





