Kadangi helio atomo išorinis elektronų sluoksnis užpildytas, įprasta manyti, kad jis su kitais atomais reaguoti ir sudaryti stabilių junginių negali.
Nors kitos inertinės dujos dideliame slėgyje rodo junginių formavimo ženklų, helio inertiškumas buvo nepajudinamas – iki šiol. Mokslininkai praneša sukūrę stabilų helio ir natrio junginį, verčiantį abejoti kai kuriomis fundamentaliausiomis šiuolaikinės chemijos prielaidomis.
„Veikiant dideliu slėgiu chemija kinta, ir tai gali vykti Žemės viduje bei kitose planetose, tarkime, Saturne“ – vienas iš komandos narių, Ivanas Popovas iš Jutos valstijos universiteto (JAV) sakė leidiniui „Gizmodo“. „Tačiau tai – vadovėlius keičiantis įvykis.“
Veikiant dideliu slėgiu chemija kinta, ir tai gali vykti Žemės viduje bei kitose planetose, tarkime, Saturne
Trumpai priminkime chemijos žinias. Helis yra antras pagal paplitimą Visatoje cheminis elementas ir priklauso šešių elementų grupei, vadinamai inertinėmis dujomis. Tokio pavadinimo jos nusipelnė savo, sakykime taip, nenoru sudaryti junginius su kitais elementais.
Tačiau kai kurios šios grupės narės išdavė pelnytą inertinių dujų reputaciją. Jas pateisinant, verta paminėti, kad reaktyvumo ženklus jos demonstravo ne savanoriškai, o tik ekstremaliomis sąlygomis. Tad inertinių dujų grupes galima padalyti į dvi dalis – kriptonas, ksenonas ir radonas inertiškumo atsisako santykinai lengvai, o štai argonas, neonas ir helis inertiškumo priesakų laikosi itin skrupulingai.
Tyrėjams buvo pavykę suporuoti helį su kitais elementais ir anksčiau, bet iki šiol rezultatai buvo labai trumpalaikiai.
Vienas iš dažniausių helio reagavimo su kitais elementais pavyzdžių susijęs su van der Waalso jėgomis – traukiančiomis arba stumiančiomis jėgomis, kurių formavimuisi nereikia įprastų kovalentinių ar joninių ryšių.
Yra žinoma, kad labai silpnos van der Waalso jėgos egzistuoja tarp helio ir kitų elementų atomų ir kad itin žemoje temperatūroje helis gali suformuoti van der Waalso jungčių pagrindo molekules – labai silpnai susijusių atomų ar molekulių santalkas – bet jos negali ilgai išlikti.
Itin aukštas slėgis, koks yra Žemės branduolyje ar planetų milžinių viduje, helio chemiją drastiškai pakeičia.
Heliui nepalenkiamą stabilumą suteikia užpildytas išorinis jo elektronų apvalkalas, o tai reiškia, kad čia nėra vietos ryšiams su kitais atomais, kurie mezgami dalijantis elektronais.
Bet tai galioja tik esant sąlygoms, panašioms į vyraujančias Žemės paviršiuje.
Kadangi helis, kaip jau minėta, yra vienas labiausiai paplitusių elementų Visatoje – 23 proc. visos barioninės Visatos masės sudaro helis – ir dalyvauja žvaigždžių ir dujinių planetų formavimesi, helis gali elgtis labai skirtingai kosmose ir mūsų planetos gelmėse, ir tyrėjai aptiko pirmuosius tokio keisto elgesio įrodymus.
„Itin aukštas slėgis, koks yra Žemės branduolyje ar planetų milžinių viduje, helio chemiją drastiškai pakeičia“, – svetainei phys.org. sakė vienas iš komandos narių, Aleksas Boldyrevas iš Jutos valstijos universiteto.
Mokslininkai, panaudoję „kristalo struktūros prognozavimo“ kompiuterinį modelį, nustatė, kad itin aukštame slėgyje gali susidaryti stabilus helio-natrio junginys.
Tada jie fiziškai sukūrė šį niekada anksčiau neregėtą junginį, Na₂He, deimantiniu priekalu, kuriuo jiems pavyko helio ir natrio atomus paveikti slėgiu, maždaug 1,1 mln. kartų viršijančiu Žemės atmosferos slėgį.
Šie atradimai buvo tokie netikėti, kad A.Boldyrevas su kolegomis ilgiau nei dvejus metus stengėsi įtikinti mokslo recenzentus ir žurnalų redaktorius šiuos jų rezultatus publikuoti.
Remdamasi šiais rezultatais, komanda nuspėjo, kad natris lengvai susijungs su heliu ir suformuos stabilų Na₂He junginį 10 milijonų kartų didesniame slėgyje, nei pasiektas dabar.
Ir kas įdomu, junginys susiformuoja be jokių komponentus laikančių cheminių jungčių.
„Mūsų atrastas junginys itin neįprastas: helio atomai nesuformuoja jokių cheminių jungčių, tačiau jų buvimas fundamentaliai pakeičia natrio atomų sąveiką, priverčia elektronus susitelkti kubinėse struktūros gardelių ertmėse ir paverčia medžiagą izoliatoriumi“, – pranešime sakė vienas iš tyrėjų, Xiao Dong iš Nankai universiteto Kinijoje.
Žemiau pateikiama kristalinė Na₂He struktūra – pakaitomis einantys natrio (violetiniai) ir helio (žali) atomai, su ertmėse esančiais bendrais elektronais (raudoni):
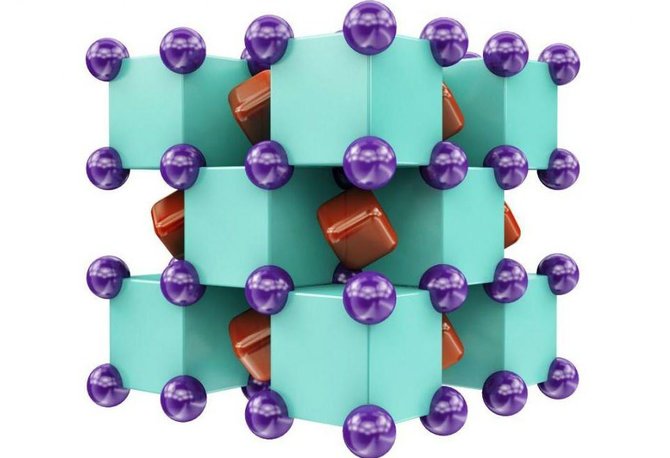
„Tai nėra tikra jungtis“, – kaip joninė ar kovalentinė, I.Popovas sakė „Gizmodo“. „Bet [helis] struktūrą stabilizuoja. Pašalinus helio atomus, struktūra nebūtų stabili.“
Štai dar pora vaizdų, – kairėje natris rožinis ir helis baltas; dešinėje – natrio ir helio kubai pilki, o elektronai raudoni:
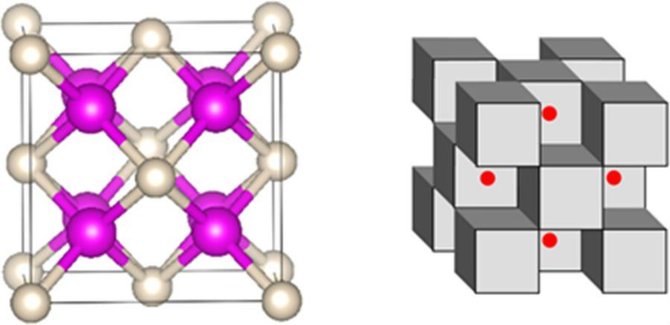
Pastaruoju metu chemikai padarė dar kelis tokius „taisykles laužančius“ atradimus, kai skirtingos komandos sukūrė pirmuosius metalinio vandenilio pavyzdžius ir anglies molekulę su šešiomis – o ne keturiomis – jungtimis.
Bet kadangi tokie atradimai prieštarauja įsigalėjusiai nuomonei, jie dažnai sutinkami itin skeptiškai, kol rezultatų nepakartoja nepriklausomi tyrėjai.
Šio tyrimo rezultatai kol kas atrodo tvirti, tad vėlesniuose eksperimentuose galime tikėtis išvysti išties įdomių rezultatų.
„Tai daug tvirtesnis mokslas“, – pastarąjį rezultatą, lygindamas su vandenilio metališkos formos gavimu, sakė su tyrimu nesusijęs fizikas Henry Rzepa, atstovaujantis Londono imperatoriškajam koledžui (JK). „Šis helio junginys yra proveržis.“
Kad būtų išsiaiškinta, kas vyksta, dar reikės atlikti daugiau eksperimentų, bet 2017-ieji jau dabar atrodo kaip metai, kai daugelis senų chemijos tiesų tikrinamos, ir labai smalsu, kas nutiks toliau.






