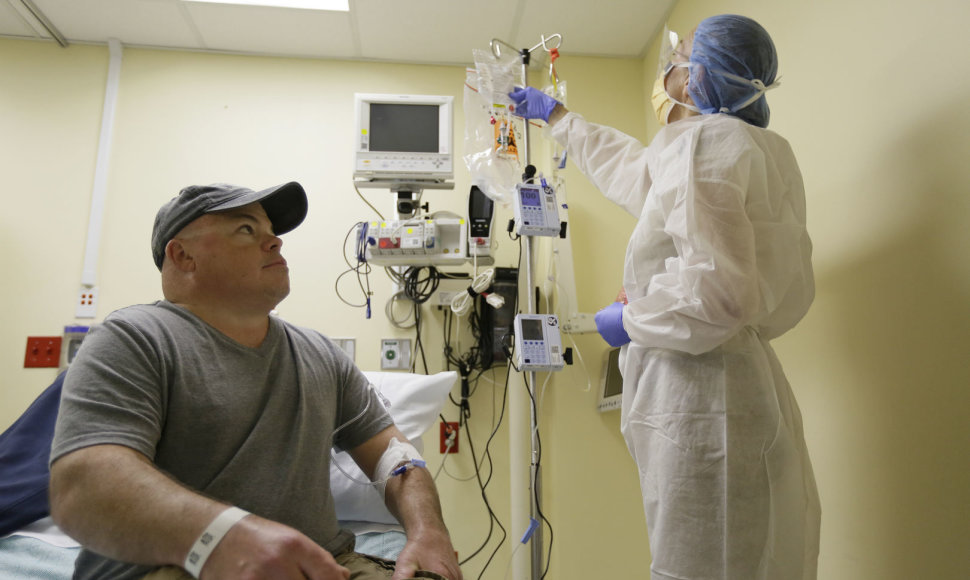
Eksperimente dalyvavęs pacientas – 44 metų Kalifornijos valstijos gyventojas Brianas Madeuxas. Jam intraveniniu būdu buvo suleisti milijardai tinkamai veikiančio geno kopijų ir genetiniai įrankiai, turintys paciento DNR perkirpti labai konkrečioje vietoje.
Metaboline liga, vadinama Hunterio sindromu, sergantis B.Madeuxas džiaugėsi galėdamas būti pirmuoju pacientu. „Esu pasiryžęs imtis šios rizikos. Tikiuosi, tai padės ir man, ir kitiems žmonėms“, – sakė jis.
Apie šios procedūros efektyvumą spręsti bus galima tik po mėnesio, o užtikrintus rezultatus, patvirtintus tyrimais, bus galima žinoti po trijų mėnesių.
Jeigu procedūra bus sėkminga, tuomet dar tik besikurianti genų terapijos sritis labai sustiprėtų. Mokslininkai ir anksčiau yra modifikavę žmonių genus – laboratorijoje jie pakoreguodavo pacientų ląsteles ir grąžindavo jas į organizmą. Be to, esama genetinės terapijos metodų, kurių metu neatliekama DNR korekcija.
Gydymo būdas yra rizikingas – jis yra negrįžtamas, nesuteikiantis galimybės ištrinti kokias nors klaidas, atsirandančias genų koregavimo procese.
Tačiau tie metodai gali būti taikomi tik ganėtinai siauram genetinių susirgimų spektrui, be to, kai kurių iš jų rezultatas nebūna ilgalaikis. Kai kurie terapiniai metodai organizmui naujus genus suteikia kaip „atsarginę dalį“, tačiau negali kontroliuoti, kurioje DNR vietoje šis genas įterpiamas, todėl baiminamasi, kad taip gali kilti ir naujų problemų – tokių, kaip onkologiniai susirgimai.
Šį kartą itin tiksli genetinė modifikacija yra vykdoma tiesiogiai paciento kūne. Ją galima būtų palyginti su mažučio chirurgo, kuris reikalingą geną atgabentų ir įstatytų į reikiamą DNR grandinės vietą, sušvirkštimu.
„Perkerpame jūsų DNR, atveriame grandinę, įterpiame geną, vėl susiuvame grandinę. Nematomas gydymas. Genas tampa jūsų DNR dalimi ir lieka ten likusiam gyvenimui“, – sakė įmonės „Sangamo Therapeutics“ prezidentė, dr. Sandy Macrae. Jos vadovaujama įmonė bando naują gydymo būdą dviem metabolinėms ligoms ir hemofilijai.
Tačiau gydymo būdas yra rizikingas – jis yra negrįžtamas, nesuteikiantis galimybės ištrinti kokias nors klaidas, atsirandančias genų koregavimo procese.
Taip iš tiesų žaidžiama su motuše Gamta
„Taip iš tiesų žaidžiama su motuše Gamta“, – sakė nepriklausomas genetikos ekspertas, Scrippso transliacinių mokslų instituto San Diege mokslininkas dr. Ericas Topolis. Jis pridūrė, kad nors visų rizikų šiuo metu žinoti negalime, tačiau tyrimai turi judėti pirmyn, nes tai yra kitais būdais nepagydomos ligos.
Atliekant šį eksperimentą su žmogumi buvo imtasi visų įmanomų saugumo priemonių, be to, su gyvūnais atlikti bandymai nuteikė optimistiškai, sakė JAV Nacionalinių sveikatos institutų tarybos, išdavusios leidimą šį tyrimą atlikti, atstovas dr. Howardas Kaufmanas.
Anot jo, genų koregavimo perspektyvos yra pernelyg didelės, kad galėtume jas ignoruoti. „Iki šiol nėra buvę jokių įrodymų, kad tai bus pavojinga. Tad dabar ne laikas bijoti“, – sakė mokslininkas.
Viso kūno liga
Metabolinėmis ligomis sergančių pacientų pasaulyje nėra daug – juos galima skaičiuoti tūkstančiais. Viena iš esminių tokio santykinai mažo ligonių skaičiaus priežastis yra ta, kad jie dažniausiai miršta labai jauni. Sergantieji Hunterio sindromu neturi geno, gaminančio fermentą, kuris skaido tam tikrus angliavandenius. Tad šie kaupiasi ląstelėse ir sukelia chaosą visame organizme.
Todėl šiuo sindromu sergantys pacientai dažnai peršąla, serga ausų infekcijomis, jų veido bruožai būna iškreipti, jie praranda klausą, jų širdis veikia nepatikimai, būna pasunkėjęs kvėpavimas, problemų būna ir su oda, akimis, kaulais, sąnariais, žarnynu, smegenimis ir mąstymu.
„Daugelis jų yra neįgaliojo vežimėlio, priklausomi nuo savo tėvų globos iki pat mirties“, – sakė Minesotos universiteto genetikos ekspertas dr. Chesteris Whitley.
Kassavaitinės trūkstamojo fermento intraveninės injekcijos šia liga sergančių pacientų simptomus gali laikinai ir iš dalies palengvinti, tačiau net itin brangios procedūros – kainuojančios nuo 100 iki 400 tūkst. JAV dolerių per metus – neapsaugo nuo smegenų pažeidimo.
Atrodo, kad man chirurginės operacijos atliekamos kiekvienais gyvenimo metais.
B.Madeuxas per savo gyvenime yra patyręs jau 26 chirurgines operacijas – dėl išvaržų, nugaros smegenis užspaudusių kaulų, ausų, akių, tulžies pūslės problemų.
„Atrodo, kad man chirurginės operacijos atliekamos kiekvienais gyvenimo metais“, – sakė pats pacientas, pridūręs, kad tarp operacijų atliekama ir daugybė kitų medicininių procedūrų. Praėjusiais metais jis vos nemirė dėl bronchito ir plaučių uždegimo. Liga smarkiai pažeidė jo kvėpavimo takus. „Skendau savo skrepliuose, negalėjau jų iškosėti“, – sakė B.Madeuxas.
Anksčiau jis dirbo virtuvės šefu, buvo dviejų restoranų Jutos valstijoje dalininkas, gamino maistą JAV olimpiečiams ir garsenybėms, tačiau dabar dėl pablogėjusios sveikatos virtuvėje dirbti nebegali.
Genų korekcija nepataisys jo jau patirtos žalos, tačiau tikimasi, kad po jos bent jau nereikės kassavaitinės gydymo fermentais procedūros.
Iš viso pirmojoje šio tyrimo fazėje turėtų dalyvauti 30 suaugusių pacientų, tačiau ilgalaikis tikslas – tokiu būdu gydyti dar labai mažus vaikus, kurių organizmai nėra negrįžtamai sužaloti.
Kaip tai veikia
Pastaruoju metu daug dėmesio žiniasklaidoje pritraukia genus koreguojantis įrankis, vadinamas CRISPR, tačiau šio tyrimo vykdytojai pasinaudojo kitokiu įrankiu, vadinamu „cinko piršto nukleazėmis“ (ZFN). Šis įrankis taip pat veikia kaip molekulinės žirklės, kurios suranda ir perkerpa labai konkrečią DNR grandinės vietą.
Ligos gydymui pakaktų, kad geną įsisavintų vienas procentas kepenų ląstelių.
Gydymo rinkinys yra sudarytas iš trijų elementų: naujo geno ir dviejų ZFN fermentų. Kiekvieno iš šių elementų genetinės instrukcijos yra patalpinamos virusuose, kurie modifikuoti taip, kad nesukeltų infekcijų, tačiau nugabentų instrukcijas į ląsteles. Per veną į organizmą patenka milijardai tokių virusų.
Pirmiausiai virusai nukeliauja į kepenis, kur ląstelėms pateikiamos instrukcijos gaminti ZNF fermentus ir paruošti sveiką geno variantą. Fermentai perkepa DNR ir paruošia vietą naujam genui įsitvirtinti. O įsitvirtinęs genas ląstelėms teikia instrukcijas gaminti trūkstamą fermentą.
Ligos gydymui pakaktų, kad geną įsisavintų vienas procentas kepenų ląstelių, sakė B.Madeuxo gydymui vadovaujantis Ouklendo ligoninės medikas, dr. Paulas Harmatzas.
„Kiek patikima ši technologija? Mes patys aiškinamės“, – sakė Pensilvanijos universiteto mokslininkas, dr. Carlas June'as. Tačiau jis pabrėžė, kad iki šiol saugumo tyrimų rezultatai buvo labai geri.
Blogiausia, kas gali nutikti
Anksčiau taikyti genetinės terapijos metodai neretai susidurdavo su saugumo problemomis. Viena iš tokio gydymo būdo grėsmių – kad medicininių „įrankių“ pernašai naudojamus virusus paciento imuninė sistema atpažins kaip priešą. 1999 m. genetinės terapijos tyrime dalyvavęs 18 metų Jesse'as Gelsingeris mirė būtent dėl tokios priežasties, tačiau naujame tyrime naudojamas kitoks virusas – tyrimais patvirtinta, kad jis yra kur kas saugesnis.
Susirūpinimą kelia ir tai, kad naujo geno įterpimas gali neprognozuojamai paveikti kitų genų veikimą. Taip buvo nutikę prieš keletą metų, kuomet mokslininkai genetinės terapijos būdu bandė šalinti imuninės sistemos sutrikimą, dėl kurio pacientas jo paties saugumui turi būti maksimaliai izoliuojamas nuo bet kokio kontakto su išoriniu pasauliu. Taip gydytiems pacientams išsivystė leukemija, nes naujasis genas netikėtai įsiterpė į tokią jų DNR vietą, kad aktyvavo suvėžėjimą lėmusį geną.
„Kai atsitiktinai kur nors įkiši DNR grandinės gabalą, kartais jis veikia gerai, kartais visai neveikia, o kartais būna žalingas. Genų modifikavimo privalumas yra tas, kad geną įterpti galima kur tik panorėję“, – sakė Stenfordo universiteto (JAV) bioetikos specialistas Hankas Greely.
Be to, baiminamasi, kad virusas gali nukeliauti ir į kitas organizmo vietas – širdį arba kiaušialąstes ir spermatozoidus. Jeigu įterptas genas patektų į reprodukcines ląsteles, jis taptų paveldimu ir paveiktų ateities kartas. Bet, anot medikų, įtaisyti genetiniai saugikliai, užtikrinantys, kad genas įsitvirtintų tik kepenyse.